La escritura está conectada con lo que somos, con nuestro estado de ánimo y con la forma en la que nos comunicamos y mostramos al exterior. La caligrafía hay que cuidarla, darle importancia y mejorarla.
¿Para qué sirve una letra que no se entiende? Piénsalo.
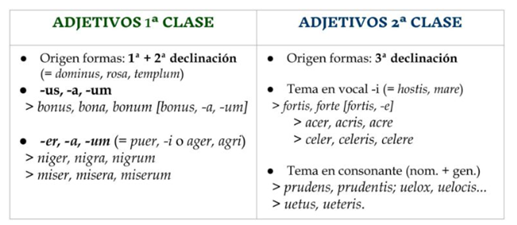
«Ayuda Activa»
¿POR QUÉ MEJORAR TU CALIGRAFÍA?
– Permite mejorar la comunicación al generar mayor claridad y rapidez de comprensión.
– Mejorarán tus notas porque los profesores podrán entender mejor tus explicaciones en los exámenes.
– Escribir bien favorece la concentración y fija mejor los conocimientos en la memoria.
– Trabajar la caligrafía desarrolla la motricidad fina (precisión y velocidad) y aumenta la sensibilidad.
– Escribir bien mejora la confianza y favorece el control emocional.
CONSEJOS PARA MEJORAR TU CALIGRAFÍA
– Realizar ejercicios de escritura (lettering) de forma rutinaria.
– Escribe a la velocidad adecuada para tu nivel, priorizando la estética sobre la rapidez.
– Trabaja la postura corporal (sentado) y el agarre del bolígrafo o lápiz.
– Escribe sobre una mesa o soporte estable y sin objetos que molesten.
– Utiliza el papel adecuado a tu nivel y sujétalo mientras escribes.
– Sé paciente y persistente para revisar y ajustar constantemente tu escritura.
EJERCICIOS RECOMENDADOS
– Trazos: se trata de escribir figuras y símbolos de forma repetida
| Líneas rectas: ||||… Líneas inclinadas: \\\\\… ///… Curvas: )))) … ((((… Símbolos: □ □ □ □… ∆∆∆…◊◊… →→→… ←←… ###… @@… >>…<<… |
– Patrones: se trata de escribir letras, números, palabras y frases de forma repetida cambiando tamaños y alturas
| Letras: aaaaa… bbbbb… ccccc… AAAA… BBBBB…. Números: 11111…. 22222….. 333….. Palabras: hola hola hola…. gato gato gato…. CASA CASA CASA…. ORDENADOR ORDENADOR….. Frases: El gato está en la puerta. El gato está en la puerta. … |
– Plantillas caligráficas: se trata de escribir sobre unas líneas de referencia



Plantillas para descargar e imprimir: